Estudio del átomo de carbono
 Es un elemento de transición entre los electrones negativos y los electrones positivos, lo que le permite unirse con igual facilidad a unos y a otros, además de poder saturar sus valencias con otros elementos, tiene la posibilidad de hacerlo consigo mismo, formando cadenas de átomos complejas y en las que se presentan frecuentes fenómenos de isomería.
Es un elemento de transición entre los electrones negativos y los electrones positivos, lo que le permite unirse con igual facilidad a unos y a otros, además de poder saturar sus valencias con otros elementos, tiene la posibilidad de hacerlo consigo mismo, formando cadenas de átomos complejas y en las que se presentan frecuentes fenómenos de isomería.
Carbenos y carbonio
Kekulé en 1857 postulo la tetravalencia constante del carbono, preparándose compuestos de carbono trivalente y hasta bivalente (carbenos), siendo estos compuestos radicales libres, iones (carbonio) y por lo tanto estados intermedios en ciertas reacciones.
El átomo de carbono se considera situado en el centro de un tetraedro regular con sus cuatro enlaces idénticos dirigidos hacia los vértices del mismo, formando entre si ángulos de 109, 28°.
Configuración electrónica
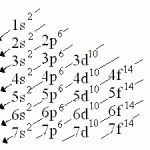 La configuración electrónica del carbono es
La configuración electrónica del carbono es ![]() , es decir, en la cuarta capa electrónica posee cuatro electrones, dos de ellos situados en un orbital
, es decir, en la cuarta capa electrónica posee cuatro electrones, dos de ellos situados en un orbital ![]() y otros en dos orbitales
y otros en dos orbitales ![]() .
.
Según Von Pauling, se encuentra en que sus orbitales atómicos, se modifican fundamentalmente cuando se les acercan los átomos o sustituyen con los que han de formar los enlaces covalentes.
El orbital ![]() , de simetría esférica y los tres orbitales
, de simetría esférica y los tres orbitales ![]() , en forma de dos lóbulos extendidos a lo largo de los ejes cartesianos, se combinan entre sí y forman cuatro orbitales idénticos llamados orbitales híbridos
, en forma de dos lóbulos extendidos a lo largo de los ejes cartesianos, se combinan entre sí y forman cuatro orbitales idénticos llamados orbitales híbridos ![]() , cuyas nubes electrónicas tienen la forma de lóbulos dirigidos hacia los cuatro vértices de u tetraedro regular, cuyo centro ocupa el átomo de carbono.
, cuyas nubes electrónicas tienen la forma de lóbulos dirigidos hacia los cuatro vértices de u tetraedro regular, cuyo centro ocupa el átomo de carbono.
Tipos de enlaces entre átomos de carbono
- Enlace doble, el orbital
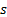 puede hibridarse con dos orbitales
puede hibridarse con dos orbitales 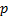 en vez de tres, dando lugar a tres orbitales híbridos denominados
en vez de tres, dando lugar a tres orbitales híbridos denominados 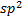 y quedando una orbita
y quedando una orbita 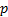 .
. - Enlace tipo π, en el que las orbitales
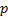 tienen forma de dos lóbulos tangentes en el núcleo del átomo, al solaparse con los del otro átomo formando dos nubes electrónicas una por encima y otra por debajo de del eje que une los dos átomos de carbono.
tienen forma de dos lóbulos tangentes en el núcleo del átomo, al solaparse con los del otro átomo formando dos nubes electrónicas una por encima y otra por debajo de del eje que une los dos átomos de carbono. - Enlace triple entre átomos de carbono, el orbital
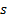 se híbrida con un solo orbital
se híbrida con un solo orbital 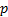 dando lugar a dos orbitales híbridos denominados
dando lugar a dos orbitales híbridos denominados 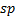 , quedando el átomo dos orbitales
, quedando el átomo dos orbitales 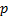 .
.
Formulación de los compuestos orgánicos
Fórmula empírica, condensada, molecular o bruta.
Ejemplo: ![]()
Fórmula desarrollada, se expresa el modo de agrupamiento de los átomos en la molécula, los enlaces o valencias se expresan indistintamente mediante puntos o trazos.
Ejemplo: 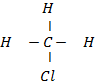
![]()
Fórmulas estereoquímicas o espaciales, se conoce la distribución;
Fórmula de proyección, se obtiene proyectando en un plano las fórmulas espaciales, para ello se ha de fijar convencionalmente una determinada posición del modelo en el espacio.
