Los metales
 Los metales son cuerpos simples con propiedades físicas distintivas, elevada resistencia mecánica, gran conductividad eléctrica y calorífica.
Los metales son cuerpos simples con propiedades físicas distintivas, elevada resistencia mecánica, gran conductividad eléctrica y calorífica.
Propiedades químicas de los elementos
- Perdida de la última orbita para transformarse en iones.
- Se combinan con oxígeno para formar óxidos.
Estado natural
Son raramente encontrar metales en estado natural, ya que siempre se encuentran combinados con el oxígeno o con otros no metales, en especial del cloro, el azufre y el carbono.
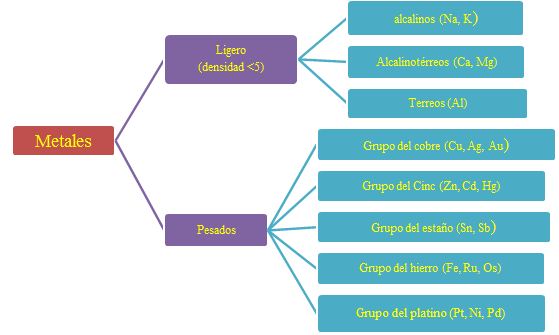
Características de la configuración electrónica
- Existencia de pocos electrones en su capa externa, por lo que se requiere escasa energía para que los pierdan y adopten la estructura estable en forma de cationes.
- Son materiales bastante densos, insolubles en agua y en muchos disolventes, y opacos con un espesor adecuado.
- Soportar grandes cargas.
- Son poco duros, dúctiles.
- Buenos conductores eléctricos y mostrar carga eléctrica positiva en los procesos de electrólisis.
La estructura formada por el conjunto de cationes y por la nube electrónica es una red cristalina, que une los iones entre sí.
Redes cristalinas de los metales | ||
Red | Índice coordinador | Como: |
Hexagonal | 12 | Be, Mg, Ca, Co, Ni, Zn, Rn, Cd y Os. |
Cúbica centrada en las caras | 12 | Sr, Fe, Co, Ni, Cu, Rh, Ag, Ir, Au |
Cúbica centrada en el espacio | 8 | Li, Na, K, Rb, Cs, Ba, Fe, Pd, Pt |
