Reacción Redox
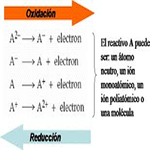 La oxidación y reducción son el anverso y el reverso de un mismo fenómeno, pues la oxidación de una sustancia sólo es posible si, al mismo tiempo, se produce la reducción de otra.
La oxidación y reducción son el anverso y el reverso de un mismo fenómeno, pues la oxidación de una sustancia sólo es posible si, al mismo tiempo, se produce la reducción de otra.
Cuando una reacción química esta igualada, las dos ecuaciones electrónicas poseen el mismo número de electrones, de modo que si dichas ecuaciones se suman miembro a miembro el número de electrones se anula.
Método del cambio de valencia
- Hallar el número de oxidación de cada uno de los elementos químicos que intervienen en la reacción, valiéndose para ello de las reglas siguientes:
- Los átomos y moléculas poseen un número de oxidación igual a cero;
- El número de oxidación del oxígeno es
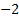 , excepto en los peróxidos que es
, excepto en los peróxidos que es 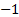 .
. - El hidrógeno al reaccionar con no metales posee el numero de oxidación
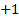 y al reaccionar con los metales, el
y al reaccionar con los metales, el 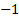 .
. - Los alcalinos poseen el número de oxidación
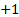 y los alcalinotérreos, el
y los alcalinotérreos, el 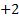 ;
; - La suma algebraica de los números de oxidación de los elementos que constituyen una molécula es siempre nula.
- Plantear las ecuaciones electrónicas correspondientes a los elementos que se oxidan así como de los que se reproducen.
- Igualar el número de electrones de las ecuaciones electrónicas multiplicándolas después por factores adecuados.
- Sumar miembro a miembro las ecuaciones que resultan.
- Completar los coeficientes de la reacción original utilizando el método de tanteo.
Ejemplo:
Igualar la reacción:
![]()
– Obtención de los números de oxidación:
![]()
![]()
Se escribirá:
![]()
– Planteo de las ecuaciones electrónicas:
![]()
![]()
– Igualación de electrones
![]()
![]()
– Suma miembro a miembro de las dos últimas ecuaciones:
![]()
- No se coloca
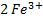 por que corresponde al
por que corresponde al 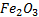 no se puede repetir dos veces)
no se puede repetir dos veces) - Traslado de coeficientes de reacción inicial:
![]()
– Ajuste final:
No es preciso pues, como se observa, son iguales el número de átomo de cada elemento en cada uno de los miembros.
