Números cuánticos
 Los números cuánticos son parámetros que permiten expresar la situación y propiedades de los electrones en los orbitales.
Los números cuánticos son parámetros que permiten expresar la situación y propiedades de los electrones en los orbitales.
Representación y denominación de los números cuánticos
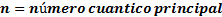 , ya que introducido por Bohr y que hoy se acepta que exprese la distancia media del electrón de núcleo; sus valores son
, ya que introducido por Bohr y que hoy se acepta que exprese la distancia media del electrón de núcleo; sus valores son 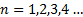
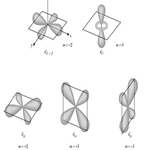
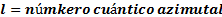 , indica el subnivel
, indica el subnivel 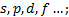 sus valores van desde 0 hasta n 1, su fórmula es:
sus valores van desde 0 hasta n 1, su fórmula es: 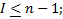
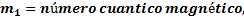 expresa la orientación especial del electrón en el campo magnético que crea al girar alrededor del núcleo. Tal orientación se indica por la dirección de los orbitales. Existen tres direcciones fundamentales que son representadas por
expresa la orientación especial del electrón en el campo magnético que crea al girar alrededor del núcleo. Tal orientación se indica por la dirección de los orbitales. Existen tres direcciones fundamentales que son representadas por 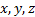 , caben tres tipos de orbitales
, caben tres tipos de orbitales 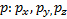 . Ejemplo:
. Ejemplo:
Una orbital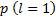 de la órbita
de la órbita 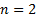 orientado según un eje o dirección
orientado según un eje o dirección 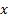 se representa por el símbolo
se representa por el símbolo 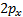 .
.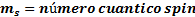 , que expresa el sentido de giro del electrón sobre su propio eje, este movimiento puede realizarse en dos sentidos, que se representan mediante los valores
, que expresa el sentido de giro del electrón sobre su propio eje, este movimiento puede realizarse en dos sentidos, que se representan mediante los valores 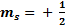 , si el giro se efectúa en sentido contrario al de las agujas del reloj; y
, si el giro se efectúa en sentido contrario al de las agujas del reloj; y 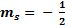 , en caso contrario.
, en caso contrario.
Los pines se representan también mediante las flechas![]() , el positivo, y
, el positivo, y ![]() el negativo.
el negativo.
El principio de exclusión de Pauli
Dice que, “en un mismo orbital existen a lo sumo dos electrones y cada uno de ellos posee un spin opuesto al del otro”.
Distribución de los electrones en los niveles y subniveles cuánticos
El número máximo de electrones que puede haber en una órbita es igual a ![]() .
.
| DISTRIBUCION DE LOS ELETRONES | |||||
| ORBITA | Número máximo de electrones en cada orbita | Distribución electrónica por subniveles (el número de exponentes indican el número de electrones que existen en cada subnivel) | |||
| Notación literal | Notación numérica (n) | ||||
| K | 1 | ||||
| L | 2 | ||||
| M | 3 | ||||
| N | 4 | ||||
Para averiguar la distribución electrónica de un átomo se debe seguir la regla de Hund:
Un electrón solo puede completar un orbital cuando todos los orbitales del subnivel contengan ya un electrón cada uno.
Es decir, si el átomo posee cuatro electrones, dos de ellos ocupan el orbital ![]() mientras que los otros dos se sitúan en el subnivel
mientras que los otros dos se sitúan en el subnivel ![]() . Como este subnivel esta constituido por tres orbitales,
. Como este subnivel esta constituido por tres orbitales, ![]() , los electrones pasarán, uno de ellos, al orbital
, los electrones pasarán, uno de ellos, al orbital ![]() y el otro
y el otro ![]() .
.
Si el átomo tuviera cinco electrones, el quinto pasaría al orbital ![]() y si el átomo poseyera seis electrones, el sexto ya puede ocupar, completándolo,
y si el átomo poseyera seis electrones, el sexto ya puede ocupar, completándolo,
