Hipótesis de Avogadro
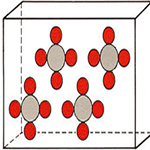 Dicha hipótesis se expresa así “Volúmenes iguales de gases diferentes contienen el mismo número de moléculas si se hallan en iguales condiciones de presión y temperatura”.
Dicha hipótesis se expresa así “Volúmenes iguales de gases diferentes contienen el mismo número de moléculas si se hallan en iguales condiciones de presión y temperatura”.
En condiciones normales, un mol de cualquier gas ocupa 22,4 litros (volumen molar) y contiene aproximadamente ![]() moléculas (número de Avogadro).
moléculas (número de Avogadro).
Una ecuación química es la representación de un proceso químico atreves de una igualdad en la que se cumple el principio de conservación de la materia; por tanto, el número de átomos de cada clase que figuran en los miembros de la igualdad ha de coincidir.
Ejemplo:
![]()
Esto dado por el método de ajuste o igualación de ecuaciones químicas.
Maneras de realizar ajustes
– Ajuste por el método de tanteo: se comparan de uno a uno los distintos elementos que figuran en la reacción. Si un elemento cualquiera, X, figura, por ejemplo, en el primer miembro con el subíndice 2 y el segundo con el 1 sin subíndice, entonces, en principio, se ha de colocar el coeficiente 2 a la izquierda de la fórmula del segundo miembro que contiene el elemento X. Tal proceder se sigue sistemáticamente con los restantes elementos, lo que obliga a veces a modificar alguno de los coeficientes ya escritos.
Ejemplo:
Iguálese, la reacción: ![]()
ELEMENTO | NÚMERO DE ÁTOMOS EN EL PRIMER MIEMBRO | NÚMERO DE ÁTOMOS EN EL SEGUNDO MIEMBRO |
H | 2 | 2 |
O | 2 | 1 |
Por tanto, en principio, el hidrógeno ya está igualado; para ajustar el oxígeno, sin embargo, se coloca el coeficiente 2 a la molécula ![]() con ello, la ecuación quedará:
con ello, la ecuación quedará:
![]()
El balance, puesto que el coeficiente 2 afecta tanto al H como al O del agua, es:
ELEMENTO | NÚMERO DE ÁTOMOS EN EL PRIMER MIEMBRO | NÚMERO DE ÁTOMOS EN EL SEGUNDO MIEMBRO |
H | 2 | 4 |
O | 2 | 2 |
Por lo tanto, se deberá añadir el coeficiente 2 al ![]() del primer miembro (ya que 2
del primer miembro (ya que 2![]() 2 = 4);
2 = 4);
![]()
Con lo que ya se tiene la ecuación ajustada y es licito colocar el singo igual entre ambos miembros.
Este método puede resultar laborioso cuando la reacción es más compleja.
Ejemplo:
![]()
ELEMENTO | NÚMERO DE ÁTOMOS EN EL PRIMER MIEMBRO | NÚMERO DE ÁTOMOS EN EL SEGUNDO MIEMBRO | COEFICIENTE |
| 1 | 2 | 2 en |
| 1 | 2 | 2 en |
| 2 | 2 | – |
| 1 | 1 | – |
| 4 + 2 | 4 + 1 | 2 en |
Aunque haya 6 átomos de oxígeno en el primer miembro y 5 en el segundo, se puede observar que en ambos lados existe el grupo ![]() ; por lo tanto, el desequilibrio surge del
; por lo tanto, el desequilibrio surge del ![]() y del
y del ![]() , lo que justifica el añadir el coeficiente 2 a la fórmula
, lo que justifica el añadir el coeficiente 2 a la fórmula ![]() . Otra observación es la de que el arreglar el
. Otra observación es la de que el arreglar el ![]() queda automáticamente igualado al
queda automáticamente igualado al ![]() .
.
En este momento la ecuación será: ![]() ,
,
en la que están igualados todos los elementos excepto el H, lo que obliga a colocar el coeficiente 2 a la izquierda de ![]() ;
;
Ahora hay desequilibrio a causa del grupo ![]() (2 en el primer miembro y 1 en el Segundo); por tanto:
(2 en el primer miembro y 1 en el Segundo); por tanto:
![]()
El anterior arreglo ha desplazado el desequilibrio al![]() (2 miembros y 4 en el segundo); en consecuencia:
(2 miembros y 4 en el segundo); en consecuencia:
![]()
– Ajuste por el método algebraico, se basa en suponer coeficientes ![]() para, una vez colocados, igualar el número de átomos de cada clase que existen en uno y otro miembro de la reacción. De este modo quedará planteado un sistema de ecuaciones, cuya solución proporcionará los valores
para, una vez colocados, igualar el número de átomos de cada clase que existen en uno y otro miembro de la reacción. De este modo quedará planteado un sistema de ecuaciones, cuya solución proporcionará los valores ![]() buscados.
buscados.
Así, en la última reacción anterior tendrá: ![]()
Igualación de ![]() :
: ![]()
Igualación de ![]() :
:![]()
Igualación de ![]() :
:![]()
Igualación de ![]() :
:![]()
Igualación de ![]() :
:![]()
Para resolver el sistema:
Han de expresarse todas las incógnitas en función de una cualquiera de ellas; ![]() en función de
en función de ![]() :
:
![]()
![]()
![]()
![]()
Se da a ![]() el menor posible de los valores que consigue que todos los coeficientes sean enteros, en este caso
el menor posible de los valores que consigue que todos los coeficientes sean enteros, en este caso ![]() , los resultados así obtenidos son las incógnitas buscadas:
, los resultados así obtenidos son las incógnitas buscadas:
![]()
![]()
Es decir:
![]()
